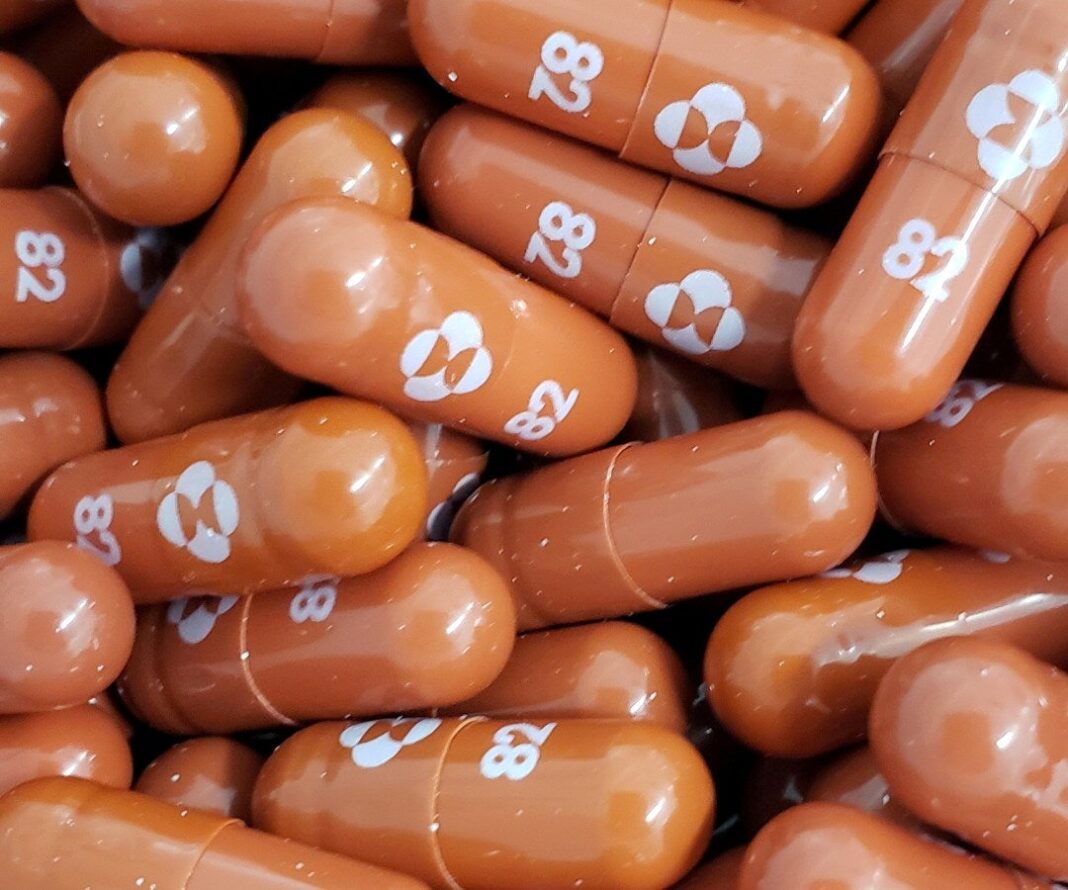
Un panel de asesores expertos de la FDA (Administración de Drogas y Alimentos) de Estados Unidos autorizó la píldora antiviral molnupiravir de Merck & Co (MRK.N) , que ya ha recibido aprobaciones regulatorias en Gran Bretaña, Dinamarca y Filipinas, entre otros.
Merck ha firmado acuerdos para vender alrededor de nueve millones de cursos de su píldora a gobiernos de todo el mundo, pero el miércoles Francia se convirtió en el primer país en decir públicamente que había cancelado su pedido luego de datos de prueba decepcionantes, y espera en cambio recibir el medicamento de Pfizer antes del final de enero.
En la Unión Europea, el tratamiento de Merck aún está siendo revisado por la Agencia Europea de Medicamentos (EMA). El 19 de noviembre, el regulador emitió un consejo sobre el uso de la píldora para adultos antes de brindar una recomendación más amplia.
La semana pasada, la EMA también dijo que los estados miembros de la UE podrían usar el medicamento de Pfizer temprano después del diagnóstico de una infección, aunque aún no se ha completado su revisión completa para la aprobación regulatoria.